Heterovalent Inhibitors of CARbohydrate processing Enzymes (Sialidases) - Inhibiteurs hétérovalents de sialidases et trans-sialidases
| Responsables(s) : | Financement(s) : |
|---|---|
 |
- Début du projet : 01/10/2017
- Fin du projet : 01/03/2021
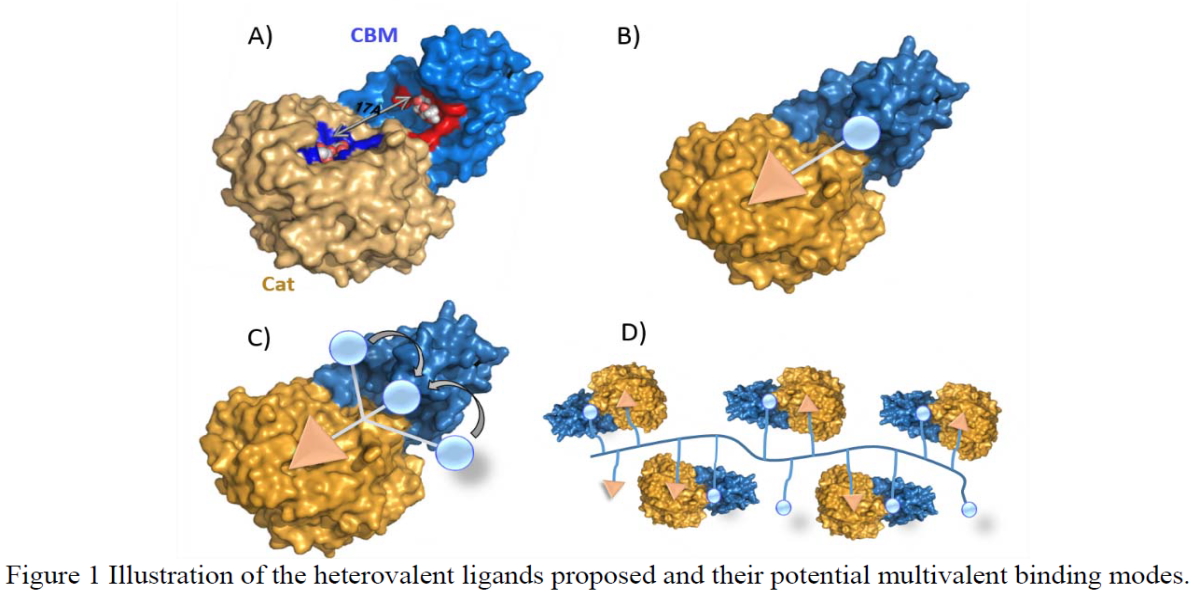
Dans un contexte problématique de résistances croissante aux antimicrobiens, l’identification de nouvelles cibles thérapeutique est d’une importance fondamentale. A ce titre, les sialidases sont des facteurs de virulence de choix. En effet elles sont exprimées sur la surface externe des pathogènes, ce qui facilite une accessibilité potentielle aux candidats médicaments qui ne devront pas traverser les membranes et qui éviteront ainsi les mécanismes internes de résistances (modifications chimiques, pompes à efflux). De nombreuses sialidases à fort intérêt thérapeutique possèdent un site lectinique de reconnaissance de sucre CBM (pour carbohydrate-binding-module) qui est bien distinct du site catalytique (CAT) de coupure. Ce CBM joue le rôle de point d’ancrage au glycans, permettant ainsi de faciliter et d’augmenter l’efficacité et la vitesse d’hydrolyse enzymatique. De façon intéressante, les sialidases humaines qui possèdent des fonctions physiologiques importantes ne possèdent pas de CBM et ce domaine apparait donc comme clef pour augmenter la sélectivité avec les sialidases de pathogènes.
Les inhibiteurs de glycosidases de première génération sont aspécifiques, et conduisent à des effets secondaires importants. Le projet HICARE est basé sur le développement d’une seconde génération d’inhibiteurs à forte affinité et sélectivité. La preuve de concept est évaluée sur une famille particulièrement importante d’enzymes: les sialidases parasitaires et bactériennes qui permettent aux pathogènes de se lier aux cellules en clivant leurs acides sialiques de surface.